國家藥監局強化醫療器械監管,通報多批次產品質量不達標情況
更新時間:2024-08-20 13:57:24 關鍵詞:醫療動態
為進一步提升醫療器械監管效能,確保公眾健康與安全,國家藥品監督管理局近期針對心電圖機、軟性接觸鏡、幽門螺桿菌抗體檢測試劑等共計10個關鍵醫療器械品種實施了嚴格的產品質量監督抽檢行動。遺憾的是,本次抽檢中發現有13批(臺)產品未能達到既定的標準規范,具體情況如下:
一、不達標產品詳情
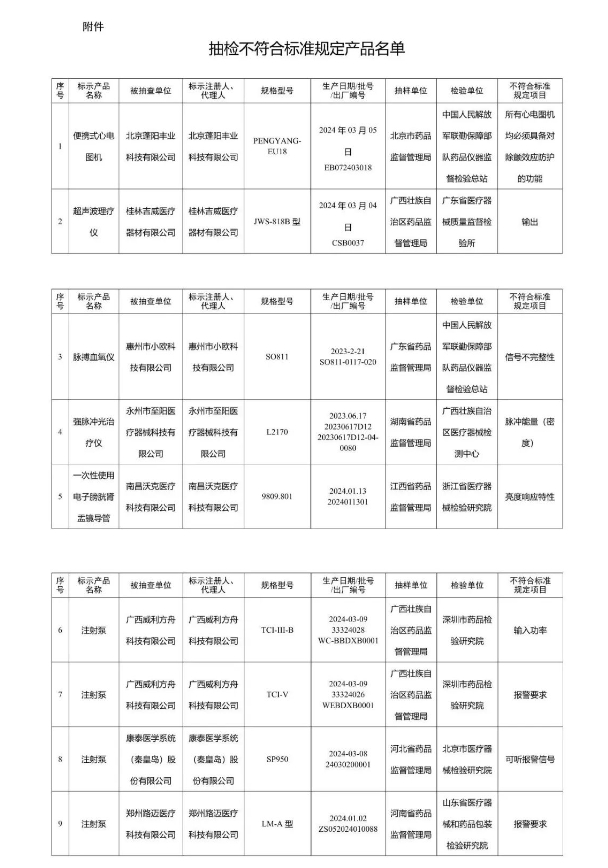
1. 心電圖機:由北京蓬陽豐業科技有限公司生產的一臺設備,因缺失對除顫效應的防護功能,被判定為不符合標準。
2. 超聲治療設備:桂林吉威醫療器材有限公司的一臺設備,其輸出性能未能達標。
3. 醫用脈搏血氧儀:惠州市小歐科技有限公司的產品,因信號完整性存在問題而被通報。
4. 強脈沖光治療儀:永州市至陽醫療器械科技有限公司的設備,脈沖能量(密度)指標不符合標準。
5. 電子內窺鏡:南昌沃克醫療科技有限公司的產品,亮度響應特性未達標。
6. 注射泵:涉及廣西威利方舟科技有限公司、康泰醫學系統(秦皇島)股份有限公司、鄭州路邁醫療科技有限公司等四家企業,問題集中在輸入功率、報警要求及可聽報警信號等方面。
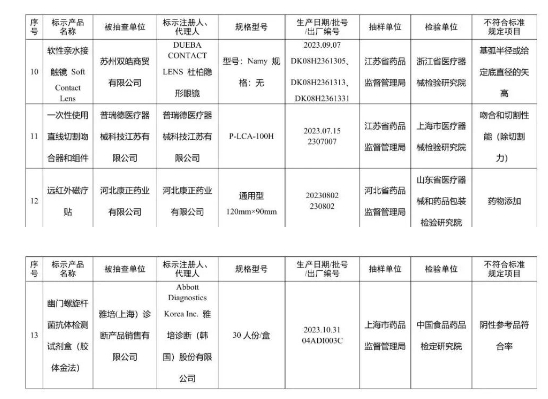
7. 軟性接觸鏡:DUEBA CONTACT LENS 杜柏隱形眼鏡的一批產品,因基弧半徑或給定底直徑的矢高不符合標準而受到通報。
8. 直線型吻(縫)合器:普瑞德醫療器械科技江蘇有限公司生產的一批產品,吻合和切割性能(除切割力)不達標。
9. 貼敷類醫療器械:河北康正藥業有限公司的遠紅外磁療貼,檢出了不應存在的藥物成分。
10. 幽門螺桿菌抗體檢測試劑:Abbott Diagnostics Korea Inc. 雅培診斷(韓國)股份有限公司生產的一批試劑,其陰性參考品符合率未達標準。
二、監管措施與要求
針對上述抽檢中發現的問題,國家藥品監督管理局已迅速行動,要求相關省級藥品監督管理部門依據《醫療器械監督管理條例》、《醫療器械生產監督管理辦法》及《醫療器械召回管理辦法》等法律法規,采取以下措施:
立即對不合格產品涉及的企業進行行政處理,并將處理結果及時向社會公開,以保障公眾知情權。
督促企業開展風險評估,根據產品缺陷的嚴重程度確定召回級別,并主動召回不合格產品,同時公開召回信息。
責令企業深入調查不合格原因,制定并實施有效的整改措施,確保在規定時間內整改到位,防止類似問題再次發生。
國家藥品監督管理局將持續加強對醫療器械生產企業的監管力度,確保每一款醫療器械產品都能達到安全、有效的標準,切實維護人民群眾的生命健康權益。